Бакозиды — главные биологически активные компоненты растения Бакопа Монье (Bacopa monnieri (L.) Wettst.), которое в индийской медицине многие столетия используется в качестве ноотропного средства. В последние годы эти соединения привлекают внимание из-за широкого спектра нейробиологических эффектов. Установлено нейропротективное действие бакозидов при воздействии различных повреждающих факторов (нейротоксинов, окислительного стресса, отложения бета-амилоида и др.). Было показано, что данные вещества снижают уровни воспалительных цитокинов и ингибируют процессы демиелинизации нейронов. Установлено противосудорожное действие бакозидов. Данные соединения также улучшают когнитивные функции, включая память и способности к обучению. Эффекты, связанные с влиянием на дофаминергическую и серотонинергическую системы стриатума, представляют интерес для терапии морфиновой зависимости. Приведены теоретические обоснования применения бакозидов в будущем в качестве многоцелевого средства комплексной терапии отдельных заболеваний в неврологической и психиатрической практике.
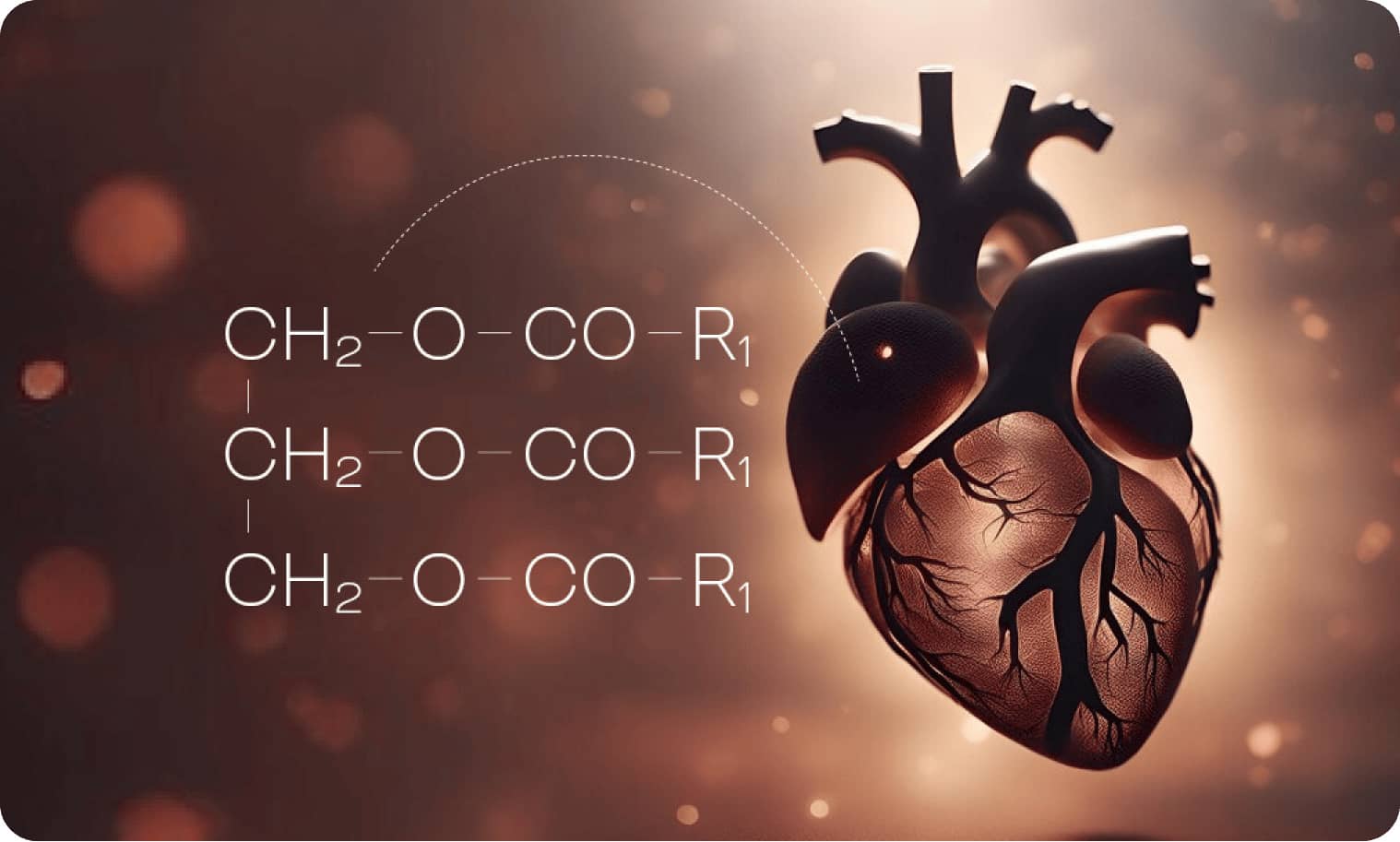
Бакозиды — главные биологически активные компоненты растения бакопа Монье (Bacopa monnieri (L.) Wettst.), которое в традиционной индийской медицине многие столетия используется как ноотропное средство]. Длительное время использовался экстракт этого растения, и после детального изучения его активных компонентов было установлено, что именно бакозиды являются основными ингредиентами, влияющими на когнитивные и психические функции. Бакозиды — это тритерпеноидные сапонины, относящиеся к производным даммарана. Выделяют бакозид A, бакозид B, который, возможно, является оптическим изомером бакозида A, и бакозид C. В последние десятилетия наблюдается повышенный интерес к изучению этих соединений. В связи с ограниченными ресурсами бакозидов в природе разрабатываются технологии их синтеза в лабораторных условиях. В эксперименте на крысах разработан метод транспортировки бакозида A в мозг при помощи наночастиц PLGA, который повышает его концентрацию в тканях мозга в 10 раз. Но особенно много экспериментальных работ посвящено выявлению у бакозидов различных нейробиологических эффектов.
Нейропротективное действие
В серии экспериментов на животных с использованием различных повреждающих факторов получены доказательства нейропротективного действия бакозидов. Механизмы реализации данного эффекта различны, но во многих случаях связаны с ингибированием окислительного стресса, который играет ключевую роль в патогенезе многих заболеваний. Эти результаты представляют особый интерес для неврологической практики.
Патологии, связанные с прогрессирующей дегенерацией нейронов, особенно такие как болезнь Альцгеймера и болезнь Паркинсона, представляют серьезное бремя не только для отдельных людей, но и для общества в целом. Признано, что нейродегенеративные заболевания являются одной из основных причин инвалидности и смертности. Препараты, используемые для лечения ряда из этих заболеваний, имеют ограниченную эффективность, что ставит задачу поиска новых лекарственных средств. Исследования показали, что бакозиды имеют потенциал для использования в лечении болезней Паркинсона и Альцгеймера. У крыс с моделью болезни Паркинсона, созданной воздействием 6-гидроксидопамина, введение бакозида A противодействовало подавлению активности каталазы и глутатионпероксидазы и, напротив, вызывало дозозависимое подавление активности ацетилхолинэстеразы и индуцируемой NO-синтазы. Лечение крыс бакозидом A значительно снизило уровни провоспалительных цитокинов — интерлейкинов (IL)-1β и -6. Наблюдалось также эффективное снижение уровней фактора некроза опухоли (TNF)-α, ядерного фактора NF-κB (p65), циклооксигеназы (COX-2), белков p53 и Bax, цитохрома C, каспаз -3 и -9. Бакозиды показали также нейропротективное действие на крысах с моделью болезни Альцгеймера. Оно проявилось в снижении негативных изменений в системе нейротрансмиссии и поведенческих парадигмах, защите нейронов от гибели и снижении маркеров окислительного стресса.
Бакозид A защищал также нейроны мозга крыс от повреждения в результате окислительного стресса, индуцированного воздействием гидрохлорида морфина. Вводимый перорально в дозе 10 мг/кг/сут за 2 ч до инъекции гидрохлорида морфина бакозид A восстановил активность антиоксидантных ферментов (глутатионпероксидазы, каталазы, супероксиддисмутазы и глутатиона) и мембраносвязанных ферментов (Na+/K+-АТФазы, Ca2+-АТФазы и Mg2+-АТФазы) до уровня, близкого к нормальному. Интересно, что у группы крыс, не получавших инъекцию гидрохлорида морфина, бакозид A не оказал никакого воздействия на активность данных ферментов. Кроме того, бакозид A снизил уровень окисления липидов и содержания карбонилированных белков.
Положительные результаты были получены при лечении бакозидом A нарушений в работе нервной системы, связанных с неонатальной гипогликемией. Неонатальная гипогликемия запускает серию событий, ведущих к гибели нейронов, нарушениям в работе дофаминергической системы коры головного мозга, когнитивным расстройствам. У новорожденных крыс с гипогликемией бакозид A устранял нарушения так же эффективно, как и введение глюкозы. В частности, было восстановлено количество рецепторов дофамина D1, D2 и циклического аденозинмонофосфата, связанного с работой нейромедиаторов, а также уровень супероксиддисмутазы. Также были значительно снижены гибель нейронов и экспрессия белка Bax.
Особый интерес представляют данные о механизмах защитного действия бакозида A в отношении нейронов, подвергшихся воздействию сигаретного дыма. Курение сигарет является важным фактором риска, участвующим в патогенетических путях развития целого ряда заболеваний нервной системы и некоторых психических расстройств. Сигаретный дым вызывает структурные изменения в головном мозге. В частности, происходит снижение целостности микроструктуры белого вещества и объемов серого вещества. Эти процессы сопровождаются когнитивными нарушениями. В эксперименте крысы в течение 12 недель подвергались воздействию сигаретного дыма. Это привело к появлению в головном мозге крыс модельной группы гистологических изменений воспалительного характера и повышению уровня апоптоза нейронов. Они сопровождались повышенной активностью изофермента CK-MB в сыворотке крови, который является ранним маркером патологических изменений головного мозга, увеличением высвобождения ацетилхолина, повышением уровня эпинефрина, норэпинефрина и котинина в мозге. Была нарушена работа митохондрий и связанных с ними аэробных путей. В экспериментальной группе, которая в течение 12 нед вместе с воздействием дыма ежедневно перорально получала бакозид A в дозе 10 мг/кг, патологические изменения оказались значительно менее выраженными. Было отмечено уменьшение воспалительных изменений в головном мозге. Бакозид A предотвращал апоптоз нейронов путем повышения экспрессии антиапоптотических (Bcl2) и снижения проапоптотических (Bax и каспаза-3) факторов. Отмечалось снижение активности изофермента CK- MB, уровней ацетилхолина (за счет повышения активности ацетилхолинэстеразы), эпинефрина, норэпинефрина и котинина. Защита митохондрий основывалась на предотвращении и в них перекисных изменений. В серии исследований было установлено также, что бакозид A защищает мозг от других повреждений, связанных с воздействием сигаретного дыма: уменьшает окислительное повреждение благодаря своему антиоксидантному потенциалу, снижает уровень экспрессии белка теплового шока hsp70, защищает мембраны нейронов и нормализует активность мембраносвязанных ферментов, оказывает протективное воздействие на мембраны митохондрий.
Антиамилоидная активность
Несмотря на то что многолетние исследования болезни Альцгеймера не привели к глобальному пониманию ее патогенеза, установлено, что морфологически данный патологический процесс связан с образованием сенильных бляшек (внеклеточного отложения амилоидного белка) и внутриклеточных нейрофибриллярных сплетений из гиперфосфорилированного тау-белка. Бакозид A показал свойство предотвращать β-амилоидопосредованное подавление жизнеспособности клеток. В исследовании клетки глиобластомы U87MG обрабатывали β-амилоидом через 24 ч после предварительной обработки бакозидом A3. Предварительная обработка предотвращала β-амилоид-опосредованное подавление пролиферации клеток по сравнению с клетками, не получившими обработки. При этом дозозависимо подавлялись генерация ROS, iNOS, выделение простагландина E2, сверхэкспрессия COX-2 и транскрипционного фактора NF- κB . Один из механизмов защитного действия бакозида A от отложений β-амилоида, вероятно, связан с блокированием взаимодействия олигомеров амилоидных белков с мембраной нейронов. Становится все более очевидным, что наиболее токсичными для нейронов в процессе агрегации амилоидных белков являются небольшие предфибриллярные олигомеры, которые взаимодействуют с мембранами и, вероятно, разрушают их. При этом вопрос о влиянии бакозида A на процессы фибрилляции амилоидных белков остается не до конца изученным. В одних публикациях отмечается, что бакозид A блокирует мембранные взаимодействия олигомеров β-амилоида и одновременно явно подавляет образование фибрилл Aβ42 за счет ингибирования сборки их олигомеров как в буферном растворе, так и в присутствии бислоев мембранных липидных везикул, которые, предположительно, способствуют процессу фибрилляции. В других работах, напротив, указывается, что бакозид A значительно снижает взаимодействие амилоидогенных детерминант прионного белка с мембранными билипидными слоями именно за счет ускоренной фибрилляции мембранно-активных предфибриллярных фрагментов.
Противовоспалительное действие и влияние на процессы миелинизации
Воспалительные процессы в ЦНС являются причиной возникновения целого ряда заболеваний, в отношении которых в настоящее время отсутствует эффективная и безопасная терапия. К таким заболеваниям, в частности, относится рассеянный склероз, патогенез которого связан с сочетанием воспаления и нейродегенерации. Хроническое воспаление миелиновой оболочки является решающим событием в прогрессировании этой болезни. В качестве одной из доклинических моделей рассеянного склероза используется экспериментальный аутоиммунный энцефаломиелит, при котором также наблюдается обширная демиелинизация. Пероральное введение бакозида A в дозе 10 мг/кг мышам с этой моделью привело к значительному снижению маркеров заболевания по сравнению с контролем. В частности, снизились уровни воспалительных цитокинов (IL-6, IL-17a и TNF-α) и воспалительного хемокина CCL-5. Гистологический анализ показал, что у мышей, получавших бакозид A, наблюдалось значительное уменьшение клеточных инфильтратов, повреждения нейронов и демиелинизации в ткани головного мозга. Активация микроглии играет роль в возникновении ряда заболеваний, в частности болезни Альцгеймера. В исследовании на активированных микроглиальных клетках линии N9 было установлено, что бакозид A в концентрациях 0,25—1 мг/мл значительно (p<0,05) подавлял высвобождение TNF-α и IL-6.
Противосудорожное действие
Рецепторы гамма-аминомасляной кислоты (ГАМК) являются основными медиаторами синаптического торможения и играют важную роль в предотвращении развития судорог. Дисбаланс между возбуждающей и тормозной синапической передачей в ключевых областях мозга напрямую вовлечен в патофизиологию височной эпилепсии, при которой происходит снижение ГАМК-опосредованного торможения. В серии экспериментов на крысах было показано, что лечение бакозидом A приводит к увеличению ГАМК-опосредованного торможения в различных отделах головного мозга. В экспериментах эпилепсию у крыс вызывали путем внутривенного введения пилокарпина. Экспериментальная группа также перорально получала бакозид A в дозе 150 мг/кг массы тела/день в течение 15 дней. Группа положительного контроля в той же дозе получала карбамазепин — стандартный препарат, используемый для лечения эпилепсии. Введение пилокарпина привело к снижению количества ГАМК-рецепторов в коре головного мозга у крыс. Лечение бакозидом A нивелировало эти изменения и вернуло их к значениям, сравнимым с показателями у контрольной группы. Увеличение количества рецепторов было более значительным, чем в группе, получавшей лечение карбамазепином. Бакозид A увеличил также активность фермента глутаматдекарбоксилазы, который используется в качестве маркера ГАМК-ергической активности. На поведенческом уровне лечение бакозидом A улучшило показатели пространственной памяти. В частности, показатели прохождения крысами радиального и Y-лабиринтов вернулись к уровню контрольных значений. Эти данные особенно важны, так как у больных эпилепсией наблюдаются значительное ухудшение памяти и снижение интеллекта, нарушения внимания, исполнительных функций, временно-пространственноий ориентации. Сходные результаты были получены в экспериментах, где исследовались ГАМК-рецепторы в нейронах стриатума и мозжечка.
Влияние на когнитивные функции
Формирование памяти — сложный процесс, требующий участия множества пре- и постсинаптических событий. Установлено, что различные нейротрансмиттеры в ЦНС играют ключевую роль в процессах обучения и запоминания. Серия экспериментов показала, что бакозиды проявляют положительный эффект при лечении нарушений когнитивных функций, вызванных различными нейротоксинами и другими факторами, в первую очередь за счет влияния на уровни различных медиаторов. В исследовании экспериментальная амнезия у мышей была индуцирована скополамином, нитритом натрия, а также антагонистом фактора активации тромбоцитов — BN 52021, а когнитивные функции изучались при помощи теста водного лабиринта Морриса. Было установлено, что бакозиды (30 мг/кг) значительно ослабляют антероградную амнезию, вызванную скополамином и нитритом натрия, возможно, за счет повышения уровня ацетилхолина. Кроме того, бакозиды также купировали ретроградную амнезию, вызванную BN 52021, вероятно, из-за увеличения синтеза фактора активации тромбоцитов путем повышения уровня глутамата в головном мозге.
Когнитивные нарушения являются одним из симптомов у больных шизофренией, приводящих к функциональной инвалидности. Антипсихотические препараты ухудшают когнитивные функции. В исследовании у крыс была создана модель шизофрении при помощи субхронического введения фенциклидина. Это привело к снижению когнитивных функций (тест на распознавание новых объектов) и уменьшению уровня везикулярного транспортера глутамата (VGluT2), который связан с развитием когнитивного дифицита при шизофрении, в поясной извилине. В группе, которая перед приемом фенциклидина получала бакозиды A и B, наблюдалось значительное (близкое к показателям контрольной группы) улучшение показателей когнитивных функций и увеличение уровня VGluT2 по сравнению с контрольной группой. В другом сходном по методике эксперименте было показано, что бакозиды A и B снижают у крыс с моделью шизофрении эксай-тотоксичность глутамата и восстанавливают когнитивные функции путем нормализации уровня VGluT3 в областях CA1-3 гиппокампа.
Бакозиды A и B показали положительное влияние на процесс запоминания и у здоровых животных в тестах как с отрицательным, так и с положительным подкреплением. В тесте активного избегания света, подкрепленного шоком, бакозиды в дозе 10 мг/кг, введенные перорально за 90 мин до обучения, значительно сокращали время реакции. Аналогичный эффект наблюдался и в тесте выработки условного предпочтения и отвращения к вкусу с использованием хлорида лития и зависел от дозы в диапазоне 2,5—7,5 мг/кг/сут.
Влияние на чувствительность к опиоидам и зависимость от них
Многочисленные исследования показали, что наркотическая зависимость тесно связана с модуляцией как дофаминергической, так и серотонинергической систем стриатума. Активация дофаминовой нейротрансмиссии вовлечена в усиление побудительной мотивации к стимулам, связанным с наркотиками, что приводит к наркомании. Серотонин может модулировать дофаминовую нейротрансмиссию для уменьшения вознаграждающего эффекта наркотиков. В эксперименте на мышах бакозид A, введенный перорально за 60 мин до введения морфина, значительно снижал вызванные морфином выбросы дофамина в стриатуме и повышенную локомоторную активность. Кроме того, было отмечено снижение в стриатуме концентрации метаболитов дофамина — дигидроксифенилуксусной и гомованилиновой кислот, а также метаболита серотонина — 5-гидроксииндолуксусной кислоты. Авторы исследования сделали вывод, что бакозид A обладает эффектами, которые могут быть использованы в лечении морфиновой зависимости.
Заключение
Проведенный анализ показывает, что бакозиды обладают разнородным спектром нейрохимического действия. В частности, под их влиянием происходит защита нейронов от окислительного повреждения и зависимой от бета-амилоида нейротоксичности, они снижают уровни проапоптотических факторов и провоспалительных цитокинов, оказывают протективное действие в отношении митохондрий и миелиновой оболочки нейронов. В связи с этим одной из сфер клинического применения бакозидов могут стать такие заболевания, как болезнь Паркинсона и болезнь Альцгеймера, рассеянный склероз и др. Способность бакозидов регулировать концентрацию внеклеточного глутамата также представляет интерес для терапии нейродегенеративных заболеваний и расстройств когнитивных функций у больных шизофренией. Особую ценность может представлять сочетание у данных соединений ноотропной активности с нейропротективной. Противосудорожное действие бакозидов может послужить основой для их применения при эпилепсии и других судорожных расстройствах. Эффекты, связанные с влиянием на дофаминергическую и серотонинергическую системы стриатума, могут найти применение в терапии морфиновой зависимости.
Однако в отличие значительного количества доклинических экспериментов клинические испытания этих соединений к настоящему времени отсутствуют. Практически все проведенные эксперименты касались исследования свойств совокупности бакозидов или бакозида A; фармакологическая активность бакозидов B и C остается неизученной. Поскольку бакозиды вводятся перорально, биодоступность этих высокомолекулярных соединений, а также степень преодоления ими гемато-энцефалического барьера также требуют дальнейших исследований. Во многих проведенных исследованиях отсутствуют препараты сравнения, что не всегда позволяет определить степень эффективности бакозидов. Таким образом, необходимы более обширные доклинические испытания и особенно клинические исследования данных соединений для подтверждения выявленной в экспериментах нейробиологической активности бакозидов, а также исследования по установлению терапевтических доз для человека. В целом бакозиды, по-видимому, могут найти применение в будущем в качестве многоцелевого средства комплексной терапии в неврологической и психиатрической практике.
Березуцкий М.А., Дурнова Н.А., Сигарева Л.Е., Белоногова Ю.В. Бакозиды: изучение нейробиологической активности и перспективы применения. Журнал неврологии и психиатрии им. С.С. Корсакова. 2023;123(10):54‑59.
Berezutsky MA, Durnova NA, Sigareva LE, Belonogova YuV. Bacosides: a study of neurobiological activity, prospects for application. S.S. Korsakov Journal of Neurology and Psychiatry. 2023;123(10):54‑59. (In Russ.)

.svg)
.svg)

.svg)





.png)







.png)